برای شناسایی باکتریها در نمونههای بالینی، مراحل کشت، جداسازی و تعیین هویت در آزمایشگاه باکتریولوژی انجام میگیرد. اکثر باکتریها براساس مرفولوژی، قابل شناسایی نبوده و باید آنها را در محیطهای کشت جدا کرده و سپس براساس خواص بیوشیمیایی (Biochemistry) و سرولوژیکی (Serological) تعیین هویت نمود. روند مطالعات باکتریها به دو عامل بستگی دارد که عبارتند از احتیاجات غذایی و نیازهای فیزیکی. برخی از باکتریها میتوانند تحت شرایط مختلفی رشد نموده، در حالیکه بعضی نیاز به شرایط خاصی دارند. در محیطهای کشت باید منابعی چون کربن، نیتروژن، فسفر، گوگرد، املاح معدنی دیگر و فاکتورهای رشد در اختیار باکتری قرار گیرد. باید توجه داشت مقدار این ترکیبات بهمیزان مشخصی به محیط اضافه شود، چون ممکن است افزایش غلظت آنها موجب کاهش و یا عدم رشد باکتری گردد. درضمن بایستی شرایطی چون درجۀ حرارت، pH، نیازهای اتمسفریک و… را نیز در نظر داشت.
محیطهای آزمایشگاهی را براساس ترکیبات شیمیایی و نحوۀ مصرف به دو صورت طبقهبندی مینمایند:
الف) طبقهبندی محیطهای آزمایشگاهی براساس ترکیب شیمیایی:
براین اساس، محیطها به دو دستۀ سنتتیک و غیر سنتتیک تقسیم میشوند:
اگر تمام ترکیبات سازندۀ یک محیط به درستی شناسایی و مقدار آنها نیز مشخص شده باشد. به آن محیط سنتتیک (Synthetic) گویند که خود به محیطهای ساده (Simple) و محیطهای پیچیده (Complex) تقسیم میگردد. محیطهای کشت سنتتیک عموماً منابع کربن، انرژی و نیتروژن را در قالب کربوهیدراتها و اسیدهای آمینه فراهم مینمایند. محیطهای سنتتیک ساده حاوی یک منبع کربن و انرژی مانند گلوکوز یا لاکتات، یک منبع نیتروژن و نمکهای غیرآلی به عنوان بافر هستند. ولی محیطهای سنتتیک کمپلکس علاوه بر موارد فوق حاوی اسیدهای آمینۀ پورین، پیریمیدین و دیگر فاکتورهای رشد هستند.
بهطور کلی محیطهای کشت به سه حالت مایع، جامد و نیمهجامد وجود دارد. محیطهای مایع را آبگوشت (Broth) گویند.
جهت ساختن محیطهای جامد، آگار (Agar) را به میزان ۱-۲% و در محیطهای نیمهجامد به میزان ۰٫۵-۰٫۷% اضافه مینمایند.

آگار: پلیساکاریدی است با زنجیرۀ طویل (کربوهیدرات کمپلکس) که اساساً از واحدهای (د-گالاکتوپیرانوز D-galactopyranose) ساخته شده است و از جلبک دریایی (Seaweed) بدست آید. آگار بوسیلۀ باکتریها، هضم نمیشود. در دمای ۴۸ درجۀ سانتیگراد مایع و در دمای پایینتر شروع به جامد شدن مینماید. آگار به میزان ۱-۲% به آبگوشت اضافه شده و این مخلوط پس از استریل شدن سرد شده و محیطی جامد بدست میآید که امکان ایزولشن و تفریق باکتریها را برروی سطح خود فراهم میسازد.
پپتون: ترکیباتی محلول در آب است که از هیدرولیز پروتئینها بدست میآید. هیدرولیز معمولاً به وسیلۀ آنزیمهای پروتئولایتیک مانند پپسین، تریپسین و پاپایین انجام میشود. قبلاً در آزمایشگاه میکروبشناسی، محیطهای کشت به صورت غیر سنتتیک تهیه میشد. اما امروزه محیطها به صورت تجارتی به فرم پودر یا کریستال در دسترس است که بر اساس دستورالعمل موجود برروی شیشههای محیط کشت ساخته میشوند.
ب) طبقهبندی محیطهای کشت براساس مصرف آزمایشگاهی
۱- محیطهای پایه (Basal media)
محیط سادهای هستند که تقریباً ۸۰% باکتریها در آنها رشد مینمایند. مانند آبگوشت نوترینت (Nutrient broth)، آبگوشت تریپتی کیس سوی (Trypticase soy broth) و محیط تریپتی کیس سوی آگار (Trypticase soy agar).
۲- محیطهای غنی شده (Enriched media)
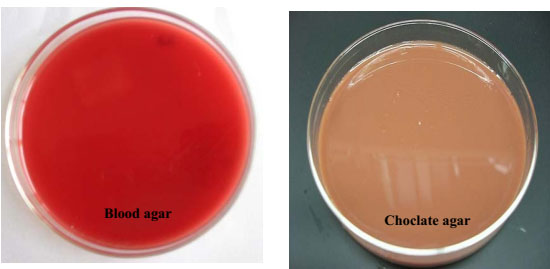
اگر به محیطهای پایه موادی مانند خون یا سرم اضافه گردد، محیطهای غنی شده ساخته میشود مانند ژلوز خوندار (Blood agar) و سرم منعقده لفلر.
بهطور مثال ژلوز خوندار محیطی است پایه که بعد از استریل و سرد شدن تا ۵۰ درجۀ سانتیگراد خون دفیبرینه گوسفند یا اسب به میزان ۵% به آن اضافه میگردد. این محیطها برای باکتریهای سخترشد مناسب میباشند.
۳- محیطهای انتخابی (Selective media)
اگر هدف از جداکردن باکتری خاص باشد، از محیطهایی استفاده میشود که برای باکتری مزبور حالت انتخابی دارد. این محیطها با اضافه کردن ترکیبات شیمیایی خاص به یک محیط سنتتیک یا غیر سنتتیک تهیه میگردند. این ترکیبات عبارتند از: رنگها (مانند کریستال ویوله) آنتیبیوتیکها، املاح صفراوی و… که از رشد گونههای دیگر جلوگیری میکند.
سایر روشهای ممانعت از رشد عبارتند از:
– تغییر در منابع کربن و انرژی
– تنظیم فشار آزموسی
– تثبیت pH
– تغییر میزان اکسیژن
باتغییر نوع و مقدار مواد ممانعت کننده میتوان محیطهای متفاوتی ساخت
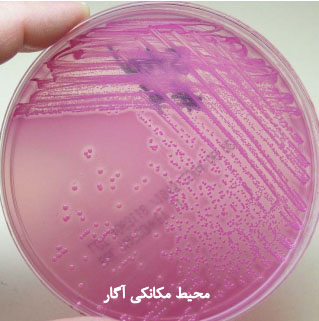
محیطهای مکانکی آگار (MacConkey agar)، سالمونلا-شیگلا (Salmonella-shigella agar) و دزوکسی کلات آگار (Desoxycholate agar) نمونههایی از این نوع هستند.
در محیط مکانکی، کریستال ویوله و نمکهای صفراوی و در محیطهای SS و DC نمکهای صفراوی ممانعت کنندۀ باکتریهای گرم مثبت (Gram positive) هستند.
۴- محیطهای افتراقی (Differential media)
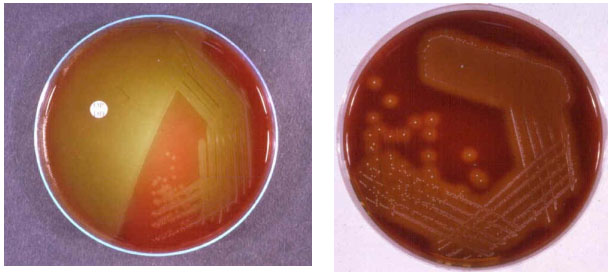
محیطهایی هستند که انواع باکتریها را از یکدیگر تمیز میدهند. این محیطها حاوی ترکیباتی بوده که در نتیجه فعالیتهای متابولیکی باکتریها، تغییر کرده و این تغییرات بوسیلۀاندیکاتور (Indicator) یا معرف قابل مشاهده است. محیطهای مکانکی و دزاکسی کلات آگار، محیطهای انتخابی و افتراقی هستند. این محیطها حاوی قند لاکتوز و معرف نوترال رد است. اگر اشریشیاکلی و سالمونلا را روی محیط آگار غذایی کشت دهیم، هردو ارگانیسم تولید پرگنه (Colony) سفید متمایل به خاکستری مینمایند. ولی اگر آنها را روی محیط مکانکی کشت دهیم، اشریشیاکلی تولید پرگنه صورتی و سالمونلا تولید پرگنه بیرنگ مینمایند. بیشتر محیطهای افتراقی، محیطهای انتخابی نیز هستند که شامل چندین فاکتور ممانعت کننده هم میباشند. مانند محیط مکانکی و بلاد اگر
۵- محیطهای غنیکننده (Enrichment media)
این محیطها حاوی ترکیباتی شیمیایی خاصی میباشند که تکثیر باکتری مورد نظر را افزایش داده و از رشد سایر باکتریها جلوگیری به عمل میآورند. مانند سلنیت . اِف (Selenit. F) و یا تتراتیونات سدیم که برای کشت سالمونلا در مدفوع مورد استفاده قرار میگیرند.
۶- محیطهای انتقالی (Transport media)
گاهی به علت طولانی شدن فاصلۀ زمان نمونهگیری تا کشت لازم است نمونه را در یک محیط انتقالی که حاوی نمک و بافر است، قرار دهند و به آزمایشگاه بفرستند. در این محیطها باکتریها رشد نکرده و در همان تعداد اولیه زنده میمانند.

عواملی که در تهیۀ محیطهای کشت باید رعایت گردد
- حلالیت: محیطهای تهیه شده باید کاملاً در آب حل شوند.
- pH: اغلب محیطهای کشت pH مشابه مایعات بدن دارند. به همین منظور در زمان تهیۀ محیط، pH را تنظیم مینمایند. ضمناً بافرهای فسفاته، سیتراته و… که در محیطهای کشت وجود دارد، از تغییرات شدید pH ناشی از رشد باکتریها در محیط کشت جلوگیری خواهد کرد.
- استریل کردن: پس از ساختن محیطهای کشت، بهمنظور ازبینبردن میکروارگانیسمهای احتمالی، بایستی آنها را استریل نمود. باید درنظر داشت که تمام ترکیبات محیط کشت در حرارت اتوکلاو پایدار مانده و تجزیه نشوند. اگر افزودن سرم، قند و آنتیبیوتیک که نسبت به حرارت حساسند، الزامی است، آنها را جداگانه با سایر روشهای فیزیکی استریل نموده و سپس در شرایط استریل به محیط کشت اضافه میکنند.
عواملی که پس از انتقال نمونه به محیط کشت باید رعایت گردد
- حرارت: محیطهای کشت را به مدت ۱۸-۲۴ ساعت در انکوباتور (Incubator) یا گرمخانه ۳۵ تا ۳۷ درجۀ سانتیگراد قرار داده، تا باکتریها رشد کنند.
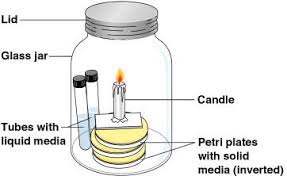
- اکسیژن: در جداسازی میکروارگانیسمها باید به نیازهای اتمسفریک آنها نیز توجه نمود. به طور مثال اگر جداسازی ارگانیسمی میکروآئروفیل مورد نظر است، باید فشار اکسیژن را کم یا محیط را در جار شمعدار (Candle jar) حاوی ۱۰-۵% گاز کربنیک، قرار داد.

اگر منظور جداسازی باکتریهای بیهوازی باشد باید به نکات زیر توجه نمود.
- افزودن مواد احیا کننده: مانند تیوگلیکولات سدیم و سیستئین به محیط کشت.
در این حالت میتوان محیط کشت مایع را در شرایط هوازی انکوبه نمود، زیرا مواد احیا کننده، اکسیژن سطحی محیط را جذب و آنرا برای باکتری غیر قابل مصرف میسازد. - افزودن اسید پیروگالیک یا کربنات سدیم: این دو ماده نیز میزان اکسیژن محیط را کم و گاز کربنیک آن را افزایش میدهند.
- استفاده از جار بیهوازی: (Anaerobic jar) متداولترین روش کشت بیهوازی استفاده از (Gaspack jar) است که استوانهای است پلاستیکی از جنس پلیکربنات که حاوی سبد توری با دانههای پالادیم و پوشش آلومینیومی به عنوان کاتالیزور است. شرایط بیهوازی در جار با استفاده از یک ژنراتور مولد هیدروژن و دیاکسیدکربن و یا با تکنیک تخلیه و جایگزینی گازهای مورد نظر حاصل میشود. این ژنراتور شامل اسید سیتریک، بیکربنات سدیم، سدیم بروهایدراید و کلراید کبالت است. پس از اضافه کردن آب با سرنگ یا پیپت به گازپک، آنرا در داخل جار قرار میدهند و درب آنرا میبندند. با انجام واکنشهای زیر شرایط بیهوازی ایجاد میشود:
a) C6H8O7 + 3NaHCO3 → Na3 (C6H5O7) + 3H2O + 3CO2
b) NaBH4 + 2H2O → NaBO2 + 4H2
CO2 ایجاد شده در واکنش اول، رشد بیهوازی را تحریک مینماید. در حضور کاتالیست، هیدروژن ایجاد شده در واکنش دوم، با اکسیژن موجود در جار تولید آب مینماید.